导语
创奇健康研究院是在大健康领域内,通过连接政策制度、技术发展、商业模式,推动产业、学术、政府、投资、媒体深度交流学习,建立一个帮助健康行业价值创新和领导者持续成长的平台。研究院受上海市卫生和健康委员会指导。
“创奇说·抗疫系列“ 是由创奇健康发展研究院策划出品的大健康行业访谈栏目,受访者来自于科研院所、政府监管部门、或产业实践。旨在探讨疫情期间具有普适性的现实问题,给出建设性、专业性的观点和建议,以期为公共卫生应急体系的建立和加强鼓与呼。
环球周磊受邀作为“创奇说·抗疫系列”第十期嘉宾接受采访。探讨了我国相关药品制度(药品特别审批、应急审批、老药新用、拓展性临床试验等)以及医疗器械方面的规定,及其在疫情中发挥的作用,并提出了规则完善建议:
• 应对疫情中,我国有怎样的审批制度保证患者及时用上有效药?这些审批制度在本次疫情中发挥了怎样的作用?
• 超适应症的“老药新用”,在本次疫情中是怎样的审批流程?
• 拓展性临床试验制度在疫情中可能发挥的作用?
• 包括核酸检测试剂盒在内的医疗器械,在本次疫情中的审批情况是怎样的?
• 如何改进和完善我国包括应急用药在内的保障制度?
提问与解答
Q1. 创奇说: 在应对疫情中,我国主要有什么特别的制度能使患者更快的用到有效药品?
周磊: 疫情中如何让患者尽早用到药,首先要回答的问题是:法律允许什么药应用到患者身上?
通常是经审批已上市的药品,一方面可通过加快审批速度,让那些试验证明针对新冠肺炎有效的药品更早上市,还有就是对发现有疗效的已上市老药进行新用,这涉及超适应症用药的问题。对未上市的还处于临床试验阶段药品,除了参与到临床试验中作为受试者,拓展性临床试验制度(类似同情用药)可能对一些重症患者的救治起到作用。此外,疫苗方面,我国还有紧急使用制度。
下图是相关路径的图示:
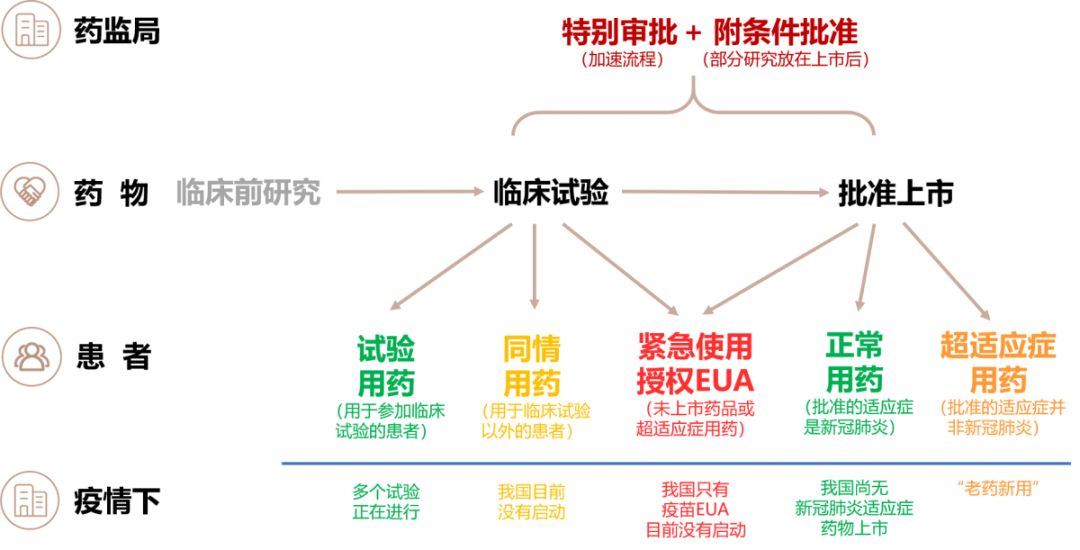
Q2. 创奇说: 加快药品审批上市方面,我国在当前疫情下是否启动了该机制?
周磊: 在突发公共卫生事件中,我国主要有两种机制加快药品审批上市:一是加快审评速度的特别审批,二是缩短临床研究时间的附条件批准上市。疫情中均有适用。
通常药品的临床试验和上市会经历长达几年的过程。而药品特别审批,从审批环节集中审评资源加快了这一流程。特别审批是一项主要为应对突发公共卫生事件设计的程序。因为是应对最紧急的情况,是我国四大药品加速上市通道中审批速度最快的。特别审批采用国家统一指挥、早期介入、快速高效、科学审批的原则。在临床试验和注册申请的各个审评环节都会以很快的速度办理。比如药监局需要在24小时内做出是否受理的决定,24小时内组织技术审评和现场核查,首轮技术审评要在15日完成。
另外,为缩短临床试验的时间,对那些公共卫生事件急需或者用于治疗严重危及生命又难治的疾病的药物包括疫苗,附条件批准制度允许申请人将部分研究留到批准上市后。如果企业没有在上市后按要求完成研究,或者上市后发现风险大于收益,那么国家药监局可以撤销批准。要获得附条件批准,一般药品需要已有临床试验数据证实疗效,并能预测其临床价值,而疫苗需要经评估获益大于风险。特别审批和附条件批准这两个途径在符合条件时是可复合使用的。
本次疫情中,截至2月25日,国家药监局已经应急审批了瑞德西韦、法匹拉韦等5个新药用于新冠肺炎防治的临床试验。据悉,瑞德西韦只用了两天获得临床试验批件。而海正药业的法匹拉韦在不到两周时间通过特别审批,获得了附条件批准上市,不过批准的适应症是成人新型或再次流行的流感,在其新冠肺炎适应症获批前,如果要直接临床使用涉及超适应症用药。
Q3. 创奇说: 讲到超适应症用药,您提到的“老药新用”在这次疫情中是怎样的审批流程?
周磊: 新药发现研究有一句名言“The best way to discover a new drug is to start with an old one”,这是1988年诺贝尔生理学或医学奖获得者苏格兰药理学家詹姆斯·布莱克提出的。在这次新冠肺炎疫情中,“老药新用”也得到了很大的关注。老药新用的优势在于其安全性已经经过验证,并且能够保证供应。
药品如要扩大注册的适应症,需要按新药申请程序进行申报,时间较长。而国家卫健委《新型冠状病毒诊疗方案》(目前已发布第七版)允许所列的(已上市)药品直接用于新冠肺炎患者,这种老药新用严格来讲是一种卫健委同意的超适应症用药。我国超适应症用药在实践中一般涉及三类情况:一类是形成专家共识的超适应症用药;另一类是确属用药不规范的超适应症用药;第三类是试验性的超适应症用药。
在试验性的超适应症用药方面,现在有大量的研究者发起的临床研究(IIT),IIT需经伦理委员会审查、由医院内部审查立项后备案。中国临床试验注册中心数据显示,截至2月27日,该中心已经注册了272项临床研究。这里面难免鱼龙混杂,对此国务院应对新冠病毒感染的肺炎疫情联防联控机制科研攻关组在2月24日,对于“老药新用”开展抗新冠肺炎治疗临床研究发布通知,提出了一些要求。
根据该通知,疫情相关的“老药新用”研究,要先上报国务院联防联控机制,经研究讨论后,由卫健委统一协调各医院开展。“老药新用”的老药,必须在体外研究或动物实验中证明对抑制新冠病毒有明确作用,而且不能超过说明书的用法用量。发现有明显毒副作用或无明确治疗效果的,应立即终止研究。研究中效果较好的药品,会被推荐至医疗救治组,组织专家研究,决定是否扩大使用范围或纳入诊疗方案。
我理解这是针对疫情中试验性的超适应症用药的统筹规定,可起到规范临床行为和保障患者利益、提高相关临床研究的整体效率、尽早发现有效已上市药、并及时扩大应用的作用。
Q4. 创奇说: 就不少人关注的瑞德西韦,在美国通过同情用药,应用给一例患者后,症状得到了较好的缓解,我国类似的拓展性临床试验制度,也能让患者更早的用到临床试验阶段的药品吗?
周磊: 拓展性临床试验在去年生效的新《药品管理法》中有很概括性的规定,17年发布的相关征求意见稿到目前为止还没有生效。我认为,拓展性临床试验虽然不是针对突发公共卫生事件设计的制度,但在疫情中可能起到救治重症患者的作用。

图片来源:unsplash
就目前新冠肺炎的发展来说,是大体满足启动拓展性临床试验的一些基本条件的,比如:适用的药物一定要是正在开展临床试验的药物,或以注册为目的的临床试验已经结束,但这个药还未在中国获批上市,包括瑞德西韦在内的正在进行临床试验的药品可以满足该要求。
患者方面,那些未能成功入组临床试验的重症患者(危及生命且无有效治疗手段)也基本满足了法规对于患者的要求。药物临床试验信息公示平台,显示两例同情方案,但暂时未见到就疫情采用同情用药的信息。
Q5. 创奇说: 除了药品,一些试剂盒、医护用品很快的获得了批准上市,请问这是药监局启动了什么样的加速审批流程?对于这些医疗器械的质量如何保障呢,比如大家关心的核酸检测试剂盒准确度的问题。
周磊: 在医疗器械领域,也有和药品特别审批类似的应急审批程序,是针对突发公共卫生事件设计的,可在审批流程上加速产品上市。适用的产品可以是为应急所需,但是我国境内尚无同类产品上市的产品,比如核酸检测试剂盒;也可以是虽有同类产品,但供应不能满足应急需要的产品,比如地方药监局负责批准的二类医疗器械口罩、防护服、手术服、隔离病床等。
这次疫情国家和地方药监局较早地启动了该应急审批程序,在补充医疗物资方面发挥了重要作用。国家局目前应急批准的试剂盒均为附条件批准。另外对器械注册证的有效期也做了特别的设置,试剂盒几乎都为1年,一些地方规定二类器械仅在疫情期间有效,这可能是出于对患者安全的谨慎考虑设置的,一定程度上也可避免一些产品利用“绿色审批通道”规避监管。
本次疫情中,研发出准确度高的新冠病毒核酸检测试剂盒对于临床早发现、早诊断、早隔离、早治疗至关重要。目前国家药监局已经应急批准注册了11个核酸检测试剂盒和6个抗体检测试剂盒。核酸检测试剂盒属于风险程度最高的第三类体外诊断试剂,通常需要在至少三家医院进行临床试验,从研发到上市一般要3-5年。
根据相关报道,本次应急审批程序中,国家药监局主动与相关企业进行沟通、筛选、指定人员进行技术答疑,这些措施起到了加速上市并一定程度上保障质量的作用。但实践中也看到检测盒“假阴性”问题比较突出,有病人需要进行多次检测才发现阳性。我个人认为,如果经科学论证得出(目前的)试剂盒不能作为“金标准”,则需要结合临床指症等进行综合的临床判断,不断改进。
李总理在近期视察国家新冠肺炎药品医疗器械应急平台时,提出了同样的试剂盒准确度的问题,有专家提出检测不准确与取样采样的方式方法、实验室自身检测条件等有关。配套的实验室设备、规范的操作流程和检测人员培训确实也需要跟上。
对于保障应急审批医疗器械(尤其是诊断试剂盒这种重要产品)的质量方面,我的一些思考是:在审批阶段,简化流程但不能省去关键环节。比如在试剂盒研发中仍需充分印证关键指标是否达到、保证足够数量的临床试验。对已批准的产品,落实法规要求的上市后监测和再评价制度,要求注册人根据临床使用状况及时改进产品技术,必要时也可撤销注册证。
Q6. 创奇说: 对于加速药品和医疗器械应用方面的规定,您有哪些具体的制度完善建议?
周磊: 我认为需要从更加整体的角度来考量目前法规制度的设计,借鉴其他国家的实践和经验,以及本次突发公共卫生事件中的这些制度实际的效果来重新审视。具体可以从两方面考虑这个问题。一是我国现有制度的细化和完善,二是考虑引入还没有的制度补充现有的应急渠道。
(1) 我国已有制度比较概括性,为更好的发挥作用,需要制定更明确的标准和指引。
药品和医疗器械应急审批方面,具体的申报方式及内容、审评标准、如何兼顾速度的同时确保安全性有效性和质量可控性、风险评估及数据收集分析、批准后追踪监管、撤市机制等尚未作出详细的规定。
图片来源:图虫创意
可以根据疫情积累的经验对上述问题进行具体规定。国家药审中心近期制定了六个内部审批规范以指导审批行为(涉及申报材料要点、临床试验申请技术指导原则和特别专家组工作程序)。
疫情结束后,我们可以考虑制定更通用的指导原则,确保在突发情况下直接有据可依,并据此更快地形成具体指导方案。另外,我国应急审批程序仅限于产品临床研究和注册阶段,突发疫情情况下是否也可考虑在产品全生命周期的监管中也设置便捷程序,比如生产GMP、药品经销、运输配送等方面。
就应对突发公共卫生事件中的“老药新用”,可以出台更具体的、法律效力层级较高的规定,以统一规范临床行为、控制临床研究中的患者资源挤兑问题、并在充分保障患者权益的基础上加快药品的超适应症研究进程。
拓展性临床试验如何在突发公共卫生事件中发挥更大作用,还有待进一步的探索和规定。例如,是否可以在紧急情况下适当扩大适用的患者人群,不限于重症患者?对药品有效性和安全性的要求是怎样的?由谁来发起?目前制度是由药企发起,在公共卫生事件中,是否可以出于公共利益需求,由卫生或药监部门来发起和主导?是否可以由政府统一部署指定医院进行较大规模的拓展性临床试验(例如多中心试验)?这些问题都有待研究。
(2) 考虑将紧急使用制度扩大到疫苗以外的其他药品和医疗器械。
我国新《疫苗管理法》规定了紧急使用授权制度,在出现特别重大突发公共卫生事件或者其他严重威胁公众健康的紧急事件时,经卫健委提议、药监局同意,允许在一定范围和期限内紧急使用(未上市的)疫苗。未来是否会在新冠病毒疫苗开展人体临床试验后启动紧急使用,要看当时是否仍对疫苗有特别紧急的需要,如果不是特别紧急但仍需尽快上市,可能会附条件批准上市。
我国目前只有疫苗的紧急使用。而美国的紧急使用授权(EUA)制度适用于所有药品和医疗器械。我国除了拓展性临床试验是紧急使用方面的规则,其他应急审批制度主要是注册审批的范畴。我国可以考虑借鉴EUA 制度,从紧急使用的角度,对我国现有制度作出补充。
EUA是在“911”事件背景下于2004年制定的,历经数次修改和完善。在2009 年应对H1N1 流感期间发挥了重要作用。本次疫情中,美国药监局就对一个体外诊断新型冠状病毒相关诊断系统,作出了紧急使用授权。EUA是在紧急情况下由美国食品药品监督管理局(FDA)做出的,授权在有限范围内使用未获批准上市的药品及医疗器械,或者将已获批的上述产品用于新的适应症。EUA可以豁免部分监管规定,如豁免伦理委员会审批、扩展处方指南,免除部分GMP要求。相关紧急状态结束后,EUA即失效,产品仍需要按正常标准申请产品注册。
(3) 加强突发公共卫生事件应急用药的机构和人员配置。
疫情期间,药监局成立了审批特别专家组。考虑到突发公共卫生事件关乎到广大民众的健康安全,可以考虑常设应对突发公共卫生事件应急用药和应急医疗器械工作组(由药学专家、审评专家和卫生政策专家等组成)。相关人员提前经过培训,熟悉应急用药方面的规则要求,保证在发生突发公共卫生事件时,根据事先的分工立即有序地开展应急用药的统筹、协调和审核工作。
(4) 进一步完善信息透明和公开。
疫情中,各界人士对相关产品的研发上市进行了积极的讨论。但我注意到由于药品和医疗器械的专业性特征,非专业人士无法较快获得准确的官方信息。我国目前暂没有便于普通公众查询的药品审评情况公开平台,相关注册流程、结果信息不易获得。信息公开透明有利于推进制度的实施,有关部门可以考虑开设专门的公开渠道,以保证相关人员的知情权,增进有关部门和医疗机构、医生及患者之间的有效沟通。
防患于未然的制度设计和预案在应对突发公共卫生事件中具有重要意义。经历了非典、甲型流感等疫情,我国初步建立了包括突发公共卫生事件应急、传染病防控等法规制度。通过积累本次疫情中的经验,相信有关部门和卫生政策专家会对(包括应急用药的保障制度在内的)相关政策进行深入的探讨和研究。