2020年6月5日,美国食品和药物管理局刑事调查办公室通过美国司法部,[1] 起诉中国广东口罩出口商兼生产商某包装印刷有限公司(以下称“出口商”),指控该公司的三项行为违反《联邦食品、药品和化妆品法案》 (Federal Food, Drug and Cosmetic Act,以下称“FDCA”),被控犯罪事实是制造虚假标贴和不合格的N95口罩以及谎称这些口罩符合相关标准后进口至美国市场。起诉书还指控出口商犯有一项重罪,即向美国食品和药物管理局(Food and Drug Administration,以下称“FDA”)提交误导性文件,构成虚假陈述。[2]
美国司法部的刑事指控,为防疫物资在华出口商敲响了警钟,在华出口企业必须重视出口业务的贸易合规法律风险,逐一检视本企业有否该案例中所指控的刑事不法行为,预先作好出口业务的法律合规工作。
一、 前三项指控:将虚假标贴器械引入州际贸易
针对出口商于2020年4月6日至21日从中国出口至美国的三批N95口罩,美国司法部指控出口商的行为构成“将虚假标贴器械引入州际贸易”(Introduction of Misbranded Devices into Interstate Commerce),违反FDCA第331条的规定。
根据FDCA第321条(a)款、(b)款,州际贸易包括美国境内的任何州或地区与境内其他州或地区之间的贸易。涉案口罩出口至美国市场后,由中间商进行跨州销售,使相关贸易落入州际贸易的范畴。
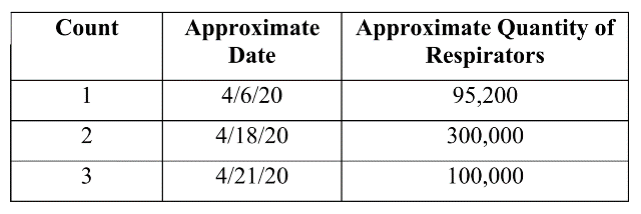
*美方前三项指控所针对的货物批次详情
对于美方认定“虚假标贴器械”的法律依据和论证,我们总结如下:
(一)“器械”(devices)
根据FDCA第321条(h)款,只有当涉案货物N95口罩用于医疗相关用途,才会被认定为FDCA所定义的“器械”,从而受到该法管辖。美方查明,涉案口罩进口至美国后,中间商将其销往医院、医疗中心等机构,由一线医务工作人员直接使用。基于此,美方指控称,涉案口罩符合医学上的“疾病预防工具”这一用途,事实上也用于医疗相关目的,因此属于FDCA定义的“器械”范畴,受到该法管辖。
需要注意的是,N95口罩本身并不必然落入医用口罩的范畴,其是否属于FDA监管的“器械”应当根据具体用途加以判断。据FDA分类[3],口罩通常分为外科口罩、N95口罩、外科N95口罩、一般口罩等类别。其中,N95口罩又依据用途分为医用与非医用口罩:医用N95口罩由FDA监管,其中,外科N95口罩属于FDA监管的“二级器械”(Class II devices);非医用口罩不受FDA监管,如工业生产中使用的N95口罩受美国国家个人防护技术实验室[4]监管。本案中,涉案口罩的本体和包装并未明示医疗用途,但是美方查明,出口商在其注册文件中将产品申报为“二级器械”,且声称用于“公共卫生医疗紧急事件”。此外,中间商亦存在将涉案口罩销往医疗机构的意图和行为。中间商指示报关代理人将涉案口罩申报为“民用N95口罩”,故FDA没有对第一批涉案口罩进行初查,口罩通关后即进入美国市场。后来美国海关与边境保护局[5]在核对货物照片时,发现第一批涉案口罩存在虚假标贴嫌疑,方才对第二、三批口罩进行查扣。
(二)“虚假标贴”(misbranded)
起诉书中,美方前三项指控的重点在于“虚假标贴”的认定。
根据FDCA第352条(a)款(1)项,如果某器械的标识是虚假或者误导性的,则该器械应当被视为“虚假标贴”器械。本案中,涉案口罩的外包装上包含FDA标识、NIOSH[6]标识,口罩本体上印有“N95”字样。然而,美方查明,涉案口罩从未获得FDA或者NIOSH的授权和批准,且经检测不符合N95口罩的最低过滤标准。[7] 基于此,美方认为涉案口罩的标签是虚假的,且具有误导消费者的作用,应当被认定为“虚假标贴”器械。

*涉案口罩外包装有NIOSH、FDA标识和“N95”字样

*涉案口罩本体上印有“N95”字样
根据FDCA第331条(a)款,将虚假标贴器械引入州际贸易,违反禁止性规定。FDCA第333条和第3551条进一步规定,若企业违反上述第331条的规定,将会面临刑事指控。因此,出口商“将虚假标贴器械引入州际贸易”的行为被美方提起刑事诉讼,并可能承担相应刑事罚金。
为尽可能避免“将虚假标贴器械引入州际贸易”的风险,医疗物资出口企业需要注意如下问题:
-
区分医疗物资和非医疗物资的分销途径,确保两类物资由中间商在进口国销售时不出现用途混同的情况;
-
依据产品检测、认证情况,如实使用器械标识,避免因为虚假或者误导性标识而被认定为假冒伪劣产品;
-
预先明确进口国对于医疗物资的检测、认证标准,基于此类标准对产品进行设计加工,避免出口后质量检测不合格的情况;
-
在FDA与NIOSH常规认证、FDA应急使用授权等流程中,[8] 企业酌情选择最适合本企业产品的流程。
二、第四项指控:虚假陈述
美方的第四项指控为虚假陈述(False Statements),矛头对准出口商的虚假证明文件以及使用虚构公司作为在美代理的行为,是四项指控中唯一的重罪指控。
《美国法典》[9]罪行与刑事诉讼部分第1001条规定了虚假陈述的三种形式,包括:(1)以任何手段、计划或手段伪造、隐瞒或掩盖重要事实;(2)作出任何重大虚假、虚构或欺诈性陈述;或(3)制作或使用任何虚假的书面材料或文件,且明知其包含重大虚假、虚构或欺诈性陈述或申报。美方指控称,出口商存在以上三种形式的虚假陈述。
(一) 包装作假掩饰质量问题
如上所述,美方指控称,通过在口罩外包装上添加NIOSH、FDA标识以及在口罩上印“N95”字样,出口商掩盖产品质量问题,属于虚假陈述。
(二) 虚假且有误导性的质量证明文件
据称,出口商持有一份由East Notice Certification Service(以下称“ENC公司”)开具的实验室检测报告,该报告证明出口商制造的口罩符合NIOSH颗粒过滤效率标准。美方查明,ENC公司是位于中国广东的检测企业,在美国属于未经认可的实验室。报告没有包括被测试口罩的型号或品牌名称,因此无法核实被测试的口罩是否为涉案口罩。此外,报告中描述的口罩图片是通用的,似乎与后来进口到美国的涉案口罩不同。之后,美国疾病控制与预防中心(Centers for Disease Control and Prevention,以下称“CDC”)对于涉案口罩的检测,结果为不符合N95的最低过滤要求。美方指控出口商提供虚假且有误导性的质量证明文件,属于虚假陈述。
(三)虚假且有误导性的注册证明文件
根据FDCA第360条(i)款(1)项以及(ii)款,外国企业如向美国出口器械,在首次交易时应立即向FDA注册。2020年3月,ENC公司为出口商开具了注册证明文件,该文件称出口商“依照化妆品自愿性注册程序在FDA注册”,且文件配有FDA标志。然而,美方查明,出口商直到2020年4月10日左右才首次向FDA注册,故美方推测ENC公司开具的证明文件系伪造。此外,由于出口商生产的口罩最早在2020年3月或前后就已进口到美国,亦说明它没有按照规定在首次从事相关出口活动时向FDA注册。美方指控出口商提供虚假且有误导性的注册证明文件,属于虚假陈述。

*ENC公司为出口商开具的注册证明
(四)利用虚构公司作为在美代理人
据美方调查,出口商的注册文件中注明以CCTC Service Inc.(以下称“CCTC公司”)作为在美代理,且列明了该公司在美国的地址、电话、邮件信息。《美国联邦法规》[10]第807.40条(b)款(2)项和第807.3条规定,外国公司的在美代理机构必须是现实存在的,并进一步规定在美代理对于FDA的辅助性义务,包括答复有关进口设备的问题、协助FDA安排对外国机构的检查等。
然而,美方查明,出口商所提供的公司地址与CCTC公司没有关联,该地址的住户从未听说CCTC公司或者出口商,且从未向FDA进行注册。此外,CCTC公司的电话从未成功接通,邮件也无回复。美方推测,CCTC公司是一家虚构公司,出口商很可能利用该虚构公司作为美国代理商,以规避对其伪劣产品的监管。据报道,已有超1300家中国医疗物资企业将CCTC公司作为其在美代理。[11] 美方指控出口商利用虚构公司作为在美代理,属于虚假陈述。
为尽可能避免触犯“虚假陈述”的风险,我们为相关医疗物资出口企业提出以下出口合规建议:
- 根据进口国认证的质量检测机构的官方名单,委托此类认证机构进行质量检测,如实提供相应的质量证明文件;
- 明确进口国对医疗器械的注册要求;
- 明确进口国关于本国代理机构的法律法规,委托符合要求的代理机构进行代理。
三、结语
美国司法部本次对在华出口商提出了四项指控,前三项指控基于出口商将虚假标贴器械引入州际贸易,第四项指控基于出口商的虚假陈述。据美国司法部公告,每项指控最高可处以50万美元的刑事罚金,或者处以违法行为总收益或总损失的两倍金额的罚金(取数额较高者进行处罚)。
近日,继该出口商之后,另一家在华医疗物资出口企业也被美国司法部提起刑事诉讼,该公司被指控出口虚假标贴KN95口罩,可能面临高达二十万美元的刑事罚金。[12] 这为相关防疫物资出口企业敲响了警钟,出口企业的贸易合规工作,势在必行。
注释
[1] 美国司法部公告:Chinese Manufacturer Charged with Exporting Misbranded and Defective Masks Falsely Purporting to be N95 Respirators, https://www.justice.gov/usao-nj/pr/chinese-manufacturer-charged-exporting-misbranded-and-defective-masks-falsely-purporting
[2] 起诉书原文:https://www.justice.gov/usao-nj/press-release/file/1283346/download
[3] N95 Respirators, Surgical Masks, and Face Masks, https://www.fda.gov/medical-devices/personal-protective-equipment-infection-control/n95-respirators-surgical-masks-and-face-masks
[4] 美国国家个人防护技术实验室,National Personal Protective Technology Laboratory,简称“NPPTL”。
[5] 美国海关与边境保护局,Customs and Border Protection,简称“CBP”。
[6] “NIOSH”,全称为National Institute for Occupational Safety and Health,中文译名为“美国国家职业安全卫生研究所”,是美国疾控中心的下属机构。
[7] NPPTL对前两个批次涉案口罩的检验报告:
https://www.cdc.gov/niosh/npptl/respirators/testing/results/MTT-2020-62.1_International_KingYearandPackaging_TestReport_Redacted-508.pdf
https://www.cdc.gov/niosh/npptl/respirators/testing/results/MTT-2020-62.2_International_KingYearandPackaging_TestReport_Redacted-508.pdf
[8] 应急使用授权,Emergency Use Authorization,简称“EUA”。FDA于2020年4月24日发布了EUA相关的指导信函,允许疫情期间对个人防护用品的应急使用授权,符合一定条件的个人防护用品可通过EUA进口,无需通过FDA常规认证程序。FDA发布的EUA相关信函:https://www.fda.gov/media/137121/download
[9] United States Code
[10] Code of Federal Regulations
[11] Over 1,300 Chinese Medical Suppliers to U.S.—Including Mask Providers—Use Bogus Registration Data, https://www.wsj.com/articles/over-1-300-chinese-medical-suppliers-to-u-s-including-mask-providersuse-bogus-registration-data-11591991270
[12] 美国司法部公告:Chinese Manufacturer Charged with Exporting Defective and Misbranded Masks Falsely Purporting to be KN95 Respirators,https://www.justice.gov/usao-nj/pr/chinese-manufacturer-charged-exporting-defective-and-misbranded-masks-falsely-purporting