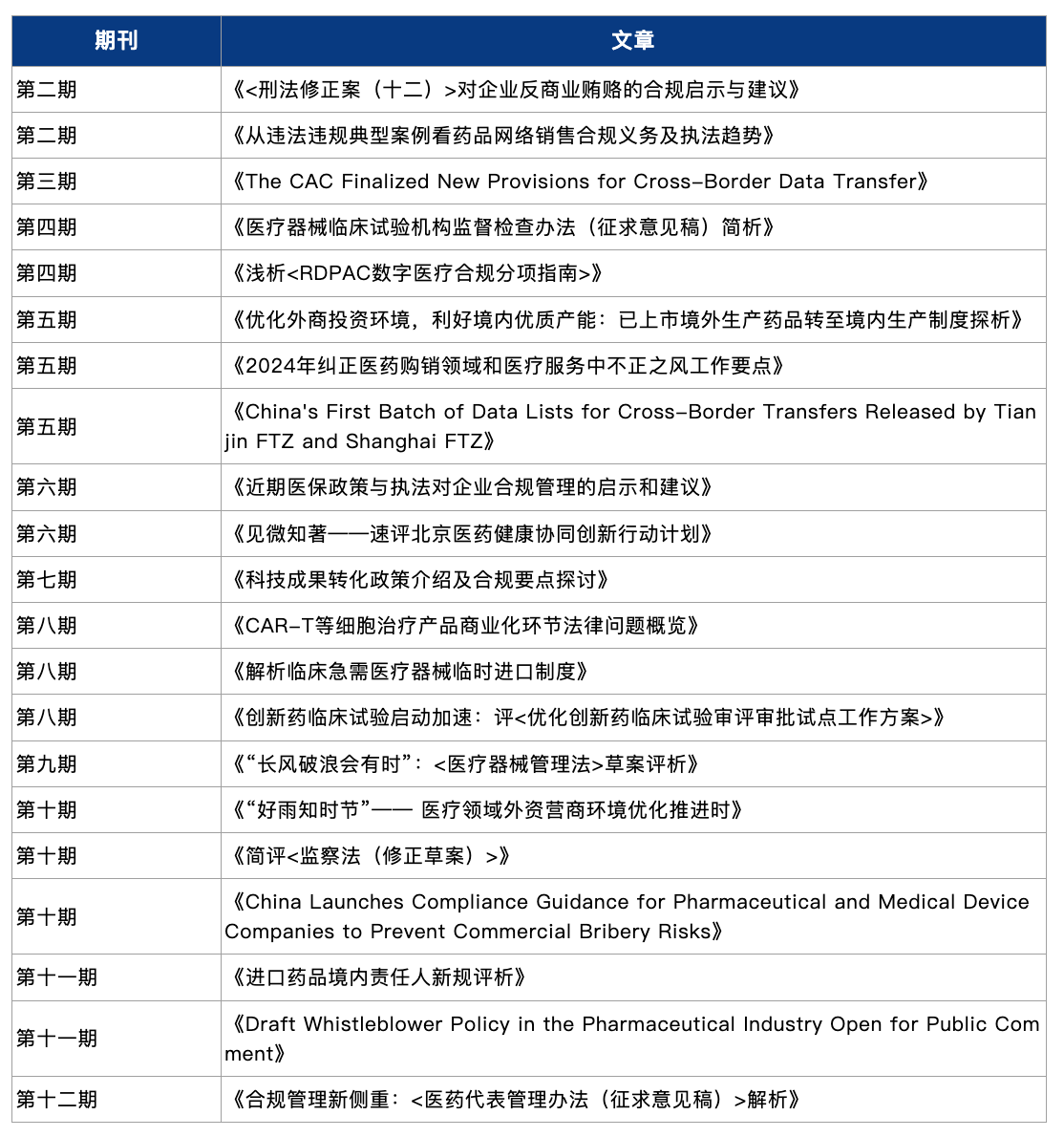
编者按
2024年中国的生命科学及医疗行业机遇与挑战并存,进一步优化营商环境、鼓励创新、常态化合规监管成为行业发展的关键词。在推进医疗、医保、医药“三医”协同发展和治理的大环境下,政策、市场、技术等要素共同发力,在继续推进企业合规管理的内部治理和外部监管的同时,持续优化营商环境,提振交易市场,赋能创新医药赛道,进一步保障中国生命科学及医疗行业的公平竞争与高质量发展。展望2025年,如何继续深化医药领域改革,推动医药创新发展,以助力健康中国建设,仍将是全行业关注的重点。
在过去的十二个月内,环球律师事务所生命科学及医疗团队从立法进展,合规监管以及行业风向等不同维度出发,搜罗热点话题撰写了十二期《环球生命科学及医疗法律专递》(“《专递》”)。在乙巳蛇年新春佳节到来之际,环球律师事务所生命科学及医疗团队基于前述《专递》之内容,对2024年影响生命科学与医疗领域的重要法律法规及政策进行梳理,希冀以法律法规及政策的更迭为基础,总结行业发展风向和合规监管要点,以飨读者。
(一)优化营商:助力医药优质产能布局,促进营商环境优化
宏观层面,政策持续推进医疗领域的扩大开放,同时明确聚焦生物技术与独资医院领域的扩大开放试点工作,助力创新医药企业扩宽海外融资渠道,促进海内外医疗资源和经验的交流协作。“地产化”已成为诸多跨国药企战略部署的重要一步,国家药品监督管理局(“国家药监局”)持续释放已上市境外生产药品转至境内生产的政策利好,激活境内优质产能、促进行业高质量发展和提高药品可及性。
医疗器械领域,为保障医疗器械安全有效和促进产业高质量发展,《医疗器械管理法(草案征求意见稿)》公开征求意见,作为医疗器械行业最高位阶法律,其生效后将成为整个行业后续相关行政法规或部门规章制订和修改的基准,对医疗器械全行业影响深远。
数据安全和个人信息保护维度,为促进数据依法有序自由流动,互联网信息监管部门通过规范数据跨境流动相关规定及其配套文件,进一步为特定数据出境情形提供了更契合行业发展的监管要求。在完善中国数据出境监管体系的同时,在降低潜在数据安全风险与减轻企业负担之间实现了平衡。
(二)赋能创新:国家与地方协同推进,落实全链条支持医药创新发展
2024年国务院在政府工作报告中首次提及“创新药”,并出台《全链条支持创新药发展实施方案》,全国多地陆续响应,发布促进创新医药高质量发展若干措施的相关文件。
国家药监局出台试点方案提升临床试验审批效能,加速创新药研发进程,而国外特定医疗器械临时进口要求有力地促进了国内械企的研发创新。相关专项监管规定的出台对细胞与基因治疗领域的药品生产流通和质量管理发挥了重要作用。
(三)常态化合规监管:事前事后治理并重
2024年监管继续聚焦医药行业生产、供销和使用等重点环节,落实全领域、全链条、全覆盖系统治理,持续完善立法与深化执法。
为进一步规范市场秩序,国家应时应需出台规范,对临床试验机构、境外MAH指定境内责任人、内部举报人、医药代表、药品网络销售相关方、CSO等行业主体,明确其合规开展活动的边界。该等规范不仅为企业提供了更明晰化的合规指引,更为市场竞争秩序规范化、营商环境的有序发展注入了活力。
值得关注的是,国家市场监督管理总局(“国家市监局”)发布首个针对医药行业防范商业贿赂的全国性合规指引,为企业合规体系建设,识别、预防、应对在商业贿赂方面的合规风险提供具有操作性的指导作用,对推动医药领域商业贿赂治理关口从事后执法向事前预防转移具有里程碑意义。
政策法规回顾
一、优化营商:助力医药优质产能布局,促进营商环境优化
(一)加大吸引外资的政策支持,激活境内优质产能并在医疗领域扩大开放
1. “地产化”推进加速,已上市境外生产药品转至境内生产迎政策利好
2024年4月《国家药监局关于优化已在境内上市的境外生产药品转移至境内生产的药品上市注册申请相关事项的公告》发布,《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(化学药品)》相继于5月发布,截至10月底,国家药监局药品审评中心已相继公布化学药品、治疗用生物制品和预防用生物制品的相关申报资料要求,为企业开展相关药品上市注册申请工作提供指导与支持。
由此展望,外商投资环境将得以进一步优化,境内受托研发生产机构等也将获取更多的海外合作契机,共同促进医药行业的高质量发展及提高药品可及性。
2. 聚焦生物技术与独资医院,医疗领域持续扩大开放
2024年9月7日,商务部、国家卫生健康委、国家药监局联合发布《关于在医疗领域开展扩大开放试点工作的通知》,明确将聚焦于生物技术领域和独资医院领域开展扩大开放试点工作。其中,生物技术领域的开放亮点主要在于外商投资企业可在试点地区从事人体干细胞、基因诊断与治疗技术开发和技术应用,以用于产品注册上市和生产。独资医院领域则拟允许在部分地区设立外商独资医院,随着2024年11月《关于印发独资医院领域扩大开放试点工作方案的通知》的发布,各试点地区例如北京、上海也纷纷响应,发布具体试点工作方案。本次试点对医疗领域的可能影响包括:生物技术领域或迎研发热潮,独资医院领域将孵化新业态、促进医疗资源交流协作,推动多元化医疗卫生服务体系发展。
-
详见《专递》第十期《“好雨知时节”—— 医疗领域外资营商环境优化推进时》
(二)促进和规范数据跨境流动,引导数字医疗活动有序开展
1. 网信办颁布新规,为企业数据跨境传输提供清晰指引
2024 年 3 月 22 日,中国国家互联网信息办公室发布的《促进和规范数据跨境流动规定》(“《数据跨境新规》”)正式生效。《数据跨境新规》对数据跨境传输相关要求进行了明确与调整,具有重要意义。《数据跨境新规》细化了数据跨境的具体要求、明确特定场景下的数据跨境传输事前监管程序的豁免情形;调整事前监管程序的触发门槛(如缩短跨境传输数据量的起算时间,剔除豁免场景下的传输数量等)。此外,《数据跨境新规》还对企业关心的诸多实操问题(如数据出境安全评估的有效期、敏感个人信息的适用、重要数据的识别等)进行了解答,为企业的数据跨境传输活动提供了更清晰的指引。
2. 自贸区先行先试,天津和上海发布中国首批数据跨境传输清单
2024年5月,天津自贸区和上海自贸区前后分别发布了数据跨境传输相关的数据清单。天津自贸区采用负面清单模式,明确需开展数据安全评估等事前监管程序的数据类型,规定未列入清单内的数据则可豁免相关事前监管程序的开展。上海自贸区则采用正面清单模式,将跨境数据分级从高到低依次分为核心数据、重要数据、一般数据3个级别,并列举了“生物医药”等领域中的一般数据字段,规定一般数据字段在满足特定管理要求时可以自由流动。两个清单都是各地自贸区在数据跨境传输监管领域进行的率先尝试,不仅有助于促进数据跨境流动,也在重要数据识别方面为企业提供了一定指导。
3. RDPAC发布数字医疗合规分项指南,指引相关企业合规开展数字医疗活动
2023年6月,中国外商投资企业协会药品研制和开发行业委员会(“RDPAC”)发布《RDPAC数字医疗合规指南》,为国内出台的首个数字医疗相关指南。2024年1月10日,RDPAC 进一步发布《RDPAC数字医疗合规分项指南》,针对与医疗卫生专业人士及医疗卫生组织、患者及患者组织互动等场景提出具体要求。例如,与患者/患者组织进行线上及线下互动时,应当注意非法诊疗、非法广告、个人信息保护等风险,可禁止医药代表在相关互动项目中直接接触患者;在电商零售药店数字化场景下,医药企业应当注意防范可能存在的纵向垄断风险。相关企业在开展数字医疗活动过程中,应当重视合规管理,强化风险识别和控制机制。
-
详见《专递》第四期《浅析
》
二、赋能创新:国家与地方协同推进,落实全链条支持医药创新发展
(一)国家层面多措并举,药械兼顾全面保障创新发展
1. 首部医疗器械监管基本法有实质立法进展,旨在激发医疗器械创新与市场主体活力
2024年8月28日,《医疗器械管理法(草案征求意见稿)》(“《草案》”)公开征求意见,医械管理迎来首部立法文件。《草案》亮点包括:(1)鼓励创新方面,强调首创及核心技术创新,鼓励交叉研究,细化创新医械优先审评审批条件;(2)明确允许注册证转让,但转让的时点、范围和具体办法等需进一步明确;(3)强化境内代理责任,提出资质要求,升级其法律责任,明确其具体义务;(4)取消强制性行业标准,改为鼓励采用推荐性标准,利于统一审评尺度;(5)建立医疗器械警戒制度,提升安全风险控制能力。
-
详见《专递》第九期《“长风破浪会有时”:<医疗器械管理法>草案评析》
2. 细化国外特定临床急需器械临时进口使用要求,有力促进国内械企研发创新
2024年7月,国家药监局和国家卫生健康委发布了《医疗机构临床急需医疗器械临时进口使用管理要求》(“《管理要求》”)。在国家已有相关制度的基础上,《管理要求》细化了临床急需器械进口制度的内容,例如需经特定三甲医院评估、递交申请、药监局审核、进口报关等;获批后要注意增加使用量需重新申请等。
-
详见《专递》第八期《解析临床急需医疗器械临时进口制度》
3. 优化创新药临床试验审评审批,助力创新药企研发与创新药上市加速
2024年7月31日,国家药监局发布《优化创新药临床试验审评审批试点工作方案》(“《工作方案》”),通过缩短IND审评审批时限、明确试点区域和机构要求、聚焦1类创新药等举措,旨在加速创新药上市速度,激发创新药企业的研发热情和创新活力,推动医药产业高质量发展。具体而言,《工作方案》将IND审评审批时限压缩至30个工作日,将试点项目范围限制在1类创新药(细胞和基因治疗产品、疫苗产品等除外),对试点机构提出例如应建立相关工作制度、有一定临床试验经验等更高的要求,对申请人也明确了临床试验经验及风险评估以及在12周内启动临床试验等要求。
-
详见《专递》第八期《创新药临床试验启动加速:评<优化创新药临床试验审评审批试点工作方案>》
4. 深化科技成果转化机制及职务科技成果赋权改革,保障科技创新成果
科技成果转化政策而言,我国目前已形成多层次的法规政策及制度指引,涵盖了国家战略、核心法律、行政法规、地方性法规等多层面。2024年7月,党的二十届三中全会《中共中央关于进一步全面深化改革推进中国式现代化的决定》提出深化科技成果转化机制及职务科技成果赋权改革,未来“创新联合体”“临床研究联合体”等创新模式有望为科研人员科技成果转化提供新途径。
-
详见《专递》第七期《科技成果转化政策介绍及合规要点探讨》
(二)地方层面积极响应,点面结合纵深推进创新落地
1. 北京制定三年行动计划,多方位支持医药健康产业创新发展
北京市政府于2024年5月23日印发了《北京市加快医药健康协同创新行动计划(2024-2026年)》,该行动计划系北京市人民政府办公厅出台的第三轮医药创新计划,具体提出了医药健康协同创新相关的34项任务。(1)创新策源方面,提出支持多种新型研发机构发展;(2)临床研究方面,强调临床研究联合体建设,优化临床试验流程,推进伦理审查结果互认等;(3)数字化赋能方面,推动数据协同整合,并进一步赋能医药健康与数据安全。该计划体现政府对医药健康产业创新的重视,有望推动产业创新发展,后续政策落地情况值得从业者进一步关注。
-
详见《专递》第六期《见微知著——速评北京医药健康协同创新行动计划》
2. 上海颁布CAR-T产品新规,为细胞与基因治疗发展提供规范化指导
细胞与基因治疗已发展成为创新药领域重要“新赛道”。2024年9月1日,上海也实施了新版的《上海市自体嵌合抗原受体T细胞(CAR-T)监督管理规定》。相比传统药物,以CAR-T(嵌合抗原受体 T 细胞)为典型代表的细胞治疗产品因其质量风险大、个体定制化等特点,其研发、生产、经营、使用等环节均需要严格管控,CAR-T产品的商业化环节有独特特点,相关主体的互动均有明显差别,如MAH对医疗机构监管职责多、治疗环节复杂、需要密切的患者跟进和管理、DTP药房参与度高、治疗费用高等等。企业需要从商业贿赂、个人信息保护、广告推广等方面注意商业化环节的合规风险。地方相关部门出台专项监管规定,对规范CAR-T细胞治疗药品生产流通和质量管理发挥了重要作用。
-
详见《专递》第八期《CAR-T等细胞治疗产品商业化环节法律问题概览》
3. 上海出台专项行动方案,推进创新药械产品海外上市
2024年9月30日,上海印发《上海市提升生物医药企业国际竞争力行动方案(2024—2027年)》(“《行动方案》”),旨在面向海外市场,加强创新产品研发,推进沪产创新药械产品海外上市。《行动方案》明确多项重点任务,加快沪产创新药械产品拓展国际市场,包括:加强具有国际竞争力的创新药械产品研发和对创新药械产品海外上市支持力度、支持企业在海外设立研发中心等分支机构、通过海外权益授权许可、国际组织采购、援建援助等方式促进创新药械产品进入国际市场、鼓励企业开展海外投资和并购、优化进出口通关便利措施等。
三、常态化合规监管:事前事后治理并重
(一)深化对腐败骗保行为的打击力度,促进行业合规发展
1. 《刑法修正案(十二)》颁布,加大对商业贿赂及内部腐败犯罪的惩治力度
在“受贿行贿一起查”的刑事政策背景下,2023年12月29日,中华人民共和国第十四届全国人民代表大会常务委员会第七次会议表决通过《中华人民共和国刑法修正案(十二)》(“《刑修(十二)》”),其自2024年3月1日起施行。《刑修(十二)》完善了关于商业贿赂犯罪的惩治规定,包括增加行贿罪从重处罚情形、调整提高涉单位贿赂犯罪的刑罚等,同时增加了惩治民营企业内部人员腐败相关犯罪,包括扩大部分背信腐败犯罪的主体范围、拓展为亲友非法牟利罪的适用场景等。《刑修(十二)》博采众长,在立法原则与技术层面取得了长足的进步,对企业反商业贿赂的合规实务带来重大且深远的影响。
-
详见《专递》第二期《<刑法修正案(十二)>对企业反商业贿赂的合规启示与建议》
2. 纠正医药购销领域和医疗服务中不正之风工作要点,推动正风反腐一体深化
2024年5月发布的纠风工作要点,是继2023年纠风工作要点发文主体由国家卫生健康委等9部门调整为14部门后的第二次纠风工作部署,共提出5大要点和15项具体要求,对医药行业生产、流通、销售、使用、报销等各领域的突出问题进行规制。整体而言,2024年纠风工作要点依然坚持“严的基调、严的措施、严的氛围”,进一步细化了对医药购销领域和医疗服务中重点问题的规制要求,也提出了一些新的整治重点及举措,建议医药企业密切关注行业监管动态,及时进行业务活动风险评估,并针对药械购销、学术推广等高风险环节建立合规应对机制。
-
详见《专递》第五期《2024 年纠正医药购销领域和医疗服务中不正之风工作要点》
3. 《监察法》完成新修,反腐力度与广度进一步加深
2024年9月10日,《监察法(修正草案)》首次提请全国人大常委会审议,系该法实施6年以来的首次修改。2024年12月25日,全国人民代表大会常务委员会正式作出关于修改《监察法》的决定(“《修改决定》”),将于2025年6月1日施行。《修改决定》共二十四条,内容包括完善监察法总则和有关监察派驻的规定、完善监察措施和监察程序、充实反腐败国际合作相关规定等,为推进监察工作规范化、法治化、正规化提供了有力保证。《修改决定》中关于监察办案措施、监察程序、监察派驻等新修内容对企业有重要影响,建议相关企业持续做好反腐败合规,开展反腐败合规体检、制度完善、合规培训、自查自纠等合规管理工作,保障企业行稳致远。
-
详见《专递》第十期《简评<监察法(修正草案)>》和《新修<监察法>要点及解读》
4. 医保专项新规与行动深入推进,国家医保基金监管日益趋严
2024年,国家打击医保诈骗行为日益趋严。从政策的角度,2024年3月两高及公安部首次出台《关于办理医保骗保刑事案件若干问题的指导意见》,明确法律适用,要求对侵犯公民个人信息、洗钱、商业贿赂同步开展调查,同时发布了典型案例,其中药企员工涉案的情况越来越受到关注。此外,相关部门还发布了《关于开展医保基金违法违规问题专项整治工作的通知》等文件。在执法层面,全国各地多个企业医药代表及管理人员涉及有关刑事调查,2024年10月哈尔滨四家药房发现的虚假处方、超量购药问题受到全国关注,50余人涉及刑事调查,国家医保局发布《关于规范医保药品外配处方管理的通知》,进一步在全国范围针对金额高、费用大、欺诈骗保风险高的开方药品开展专门检查,要求做到“五个必查”。在此情况下,企业应建立医保合规管理体系,排查风险,应对外部调查时积极配合,避免医保骗保法律风险,保障医保基金安全和医疗保障体系可持续发展。
-
详见《专递》第六期《近期医保政策与执法对企业合规管理的启示和建议》
2025年1月14日,继征求意见稿发布3个月后,国家市监局正式发布了《医药企业防范商业贿赂风险合规指引》(“《指引》”)。作为中国首部由政府监管部门发布的全国性医药行业防范商业贿赂的合规指导意见,《指引》系统地梳理并汇总了医药企业在研发、生产、流通、推广等活动中的风险活动场景,将专业性强、概括度高的法律法规予以场景化、具象化,帮助医药企业更好地理解和执行相关法律法规,对医药行业合规管理与实践将产生重大影响。正式稿中的章节体例、具体规定等相较于此前的征求意见稿均变化不大,但细节方面进一步推敲并有所完善,为医药企业及相关第三方提供了场景化、操作性强的合规参考。
(二)应时应需出台规范,明确行业各主体合规开展活动的边界
1. 加强临床试验管理,进一步规范医疗器械临床试验机构监督检查工作
国家药监局在2024年3月12日再次公开征求《医疗器械临床试验机构监督检查办法(试行)(征求意见稿)》(“《检查办法》”)《医疗器械临床试验机构监督检查要点及判定原则(二次征求意见稿)》(“《检查要点》”)意见。《检查办法》包括检查机构和人员、检查程序、检查有关工作衔接、检查结果的处理等六章内容,在职责、程序以及结果处理等方面进行了明确规范。为配合和监督检查工作的开展,《检查要点》更详细的列举了16个检查环节和96个检查项目,为医疗器械临床试验机构自查、申办者监查稽查以及进行第三方质控等都提供了更为详细的指引。考虑到和医疗器械临床试验机构的沟通中作为申办者的医疗器械研发企业较难进入医院系统获得临床试验管理相关的所有信息,亦无法在合作前通过全面尽职调查的方法对临床试验机构的质量管理体系等情况进行评估,基于此,在有限的范围内,建议医疗器械研发企业在选择临床试验机构以及临床试验合作过程中从临床试验机构选择、检查稽查与质控以及合同义务这几个方面予以关注。
-
详见《专递》第四期《医疗器械临床试验机构监督检查办法(征求意见稿)简析》
2. 规范境外MAH指定境内责任人管理,落实药品上市后质量管理主体责任
2024年11月14日,国家药监局发布《境外药品上市许可持有人指定境内责任人管理暂行规定》(“《暂行规定》”),自 2025年7月1日起施行。《暂行规定》明确境内责任人资质要求,同一主体可担任不同境外MAH或同一境外 MAH名下不同药品的境内责任人。《暂行规定》还划定由省局管辖、细化指定流程与公示要求,其中资质判定标准、各省监管差异及相关处罚影响等问题有待在实操中观察。此外,明确了境内责任人在职责承担要求,体现境内责任人在药品全生命周期与境外MAH共同承担的各项责任。《暂行规定》的出台解答了新《药品管理法》出台以来有关境外MAH指定中国境内企业法人的一系列问题。
-
详见《专递》第十一期《进口药品境内责任人新规评析》
3. 内部举报人新政征求意见,为药械质量安全提供保障
2024年10月10日,国家药监局发布《关于对药品、医疗器械质量安全内部举报人举报实施奖励的公告(征求意见稿)》(“《公告》”),旨在通过举报人激励制度加强行业监管。《公告》适用于向药品监管机构举报药品和医疗器械质量和安全方面重大违规行为的医药和医疗器械行业的内部员工和相关举报人,明确了奖励条件、分配原则、奖励程序等关键流程。同时,为防范报复和虚假举报,《公告》进一步规定了举报人保护措施及针对虚假举报的处罚机制。《公告》有助于推动企业建立内部合规机制,增强行业自律,及时纠正不正之风。
-
详见《专递》第十一期《Draft Whistleblower Policy in the Pharmaceutical Industry Open for Public Comment》
4. 医药代表管理拟升级,新规或将重塑行业
对于医药代表的管理,我国经历了点对点打击行为的萌芽阶段到目前强调药品上市许可持有人主体责任的系统性正式规范阶段。在此基础上,国家药监局于2024年11月28日发布了《医药代表管理办法(征求意见稿)》,在现有监管框架下对医药推广的各相关主体均提出了细化要求:(1)医药企业需建立管理制度、与代表订立劳动合同等,履行药品上市许可持有人主体责任;(2)代表职能严格限于药品学术推广;(3)医疗卫生机构对学术推广负有管理义务;(4)强调多部门联合监管,并且加重了违规后果。建议行业企业密切关注立法动态,从严管理推广行为。
-
详见《专递》第十二期《合规管理新侧重:<医药代表管理办法(征求意见稿)>解析》
5. 药品网络销售监管全方位多形式开展,执法力度不断加强
自《药品网络销售监督管理办法》颁布后,国家药监局陆续发布药品网络销售违法违规典型案例。2024年1月15日公布的第四批17件典型案例中包括7项违法违规行为,分别是通过网络销售假药劣药、无证销售药品、销售禁售药品、通过网络销售未取得药品批准证明文件药品、通过网络违规销售医疗机构制剂、未按规定进行处方审核和调配而销售处方药以及未从合法渠道购进药品。药监局通过许可检查、常规检查、飞行检查、第三方平台检查、专项整治和监测等措施不断加强查处力度。
-
详见《专递》第二期《从违法违规典型案例看药品网络销售合规义务及执法趋势》
本文编者:周磊、黄旭春、王舒雯、张佳琪、张旭东
特别致谢:参与2024年全年历月《环球生命科学及医疗法律专递》撰写的全部作者名单如下(按文章发布时间排序):
周磊 | 黄旭春 | 刘展 | 高永华 | 王舒雯 | 万红 | 黄丽君 | 王傲寒 | 李嘉杰 | 张旭东 | 徐瑞苑 | 范可 | 曹思思 | 代润霖 | 姜寒 | 刘晨雨 | 陈筝妮 | 徐源吕 | 张佳琪 | 张燕 | 张蕊 | 杨丛颖 | 李亚亚| 韩越 | 高诗文 | 程瑞希 | 王笑 | 吴剑雄 | 王鼎寰 | 袁修远| 戴鹏 | 许谐昱 | 张桐 | 吴骏坤 | 曹哲源 | 刘原伊
附:《专递》年终盘点文章目录